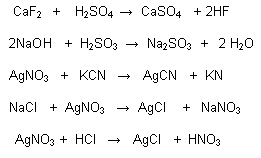Estudia las características, propiedades y composición de las sustancias, así como las reacciones de estas con otras y sus formas de obtención, la química descriptiva estudia los elementos por grupos de la tabla periódica: alcalinos, alcalinoterreos, terreos, carbonoides, nitrogenoides, anfigenos y halogenos; compuestos de elementos hidrogeno, oxigeno, nitrógeno, azufre formando hidruros, ácidos, óxidos etc.
domingo, 6 de octubre de 2013
Volatilizacion
Es el conjunto de estado que ocurre cuando una sustancia pasa del estado solido al gaseoso por aumento de la temperatura, sin pasar por el estado liquido intermedio
Cosas Quimicas en el cuerpo
- Respiración
-Maquillaje
-Tinte de Cabello
-Transpiración
-Hablar
Bañarse
-Sonreír
-Desodorante
-Digestión
-Moverse
-Producir saliva
-Maquillaje
-Tinte de Cabello
-Transpiración
-Hablar
Bañarse
-Sonreír
-Desodorante
-Digestión
-Moverse
-Producir saliva
jueves, 16 de mayo de 2013
Los Hidrocarburos
Los hidrocarburos se nombran según la cantidad de carbonos presentes en el compuesto.
Nombre Formula Quimica
Metano CH4
Etano CH3 CH3
Propano CH3 CH2 CH3
Butano CH3 (CH2)2 CH3
Pentano CH3 (CH2)3 CH3
Hexano CH3 (CH2)4 CH3
Heptano CH3 (CH2)5 CH3
Octano CH3 (CH2)6 CH3
Nonano CH3 (CH2)7 CH3
Decano CH3 (CH2)8 CH3
Undecano CH3 (CH2)9 CH3
lunes, 13 de mayo de 2013
Plastico PS
Poliestireno, polimerizacion del estireno, transparentes, quebradisos y rigido, el opaco resistente de alto.
Plastico PEBD
Es familia de los Polimeros definidos.
Esta conformado por el Etileno.
Su estructura es de Cadenas Radificadas.
Sus procesos de Conformado son: Polimerizacion de alta presion.
Esta conformado por el Etileno.
Su estructura es de Cadenas Radificadas.
Sus procesos de Conformado son: Polimerizacion de alta presion.
jueves, 9 de mayo de 2013
Hidrocarbono
Son compuestos formados por hidrógeno y carbono. Se distinguen 3 principales familias dependiendo del tipo de enlace que existe entre los átomos; Alcanos, Alquenos y Alquinos.
Alcanos: con enlaces sencillos
Alquenos: con enlace doble
Alquinos: con enlace triple
Alcanos: con enlaces sencillos
Alquenos: con enlace doble
Alquinos: con enlace triple
lunes, 6 de mayo de 2013
Plástico "PS"
"Poliestireno", polímero del estireno, transparente, quebradizo y rígido opaco y resistente de alto impacto al choque, expandido y muy liviano.
Excelente aislante térmico, absorción y transmicion del agua.
Excelente aislante térmico, absorción y transmicion del agua.
jueves, 2 de mayo de 2013
Los Plasticos
Plástico se aplica a las
sustancias de similares estructuras que carecen de un punto fijo de evaporación
y poseen durante un intervalo de temperaturas propiedades de elasticidad y
flexibilidad que permiten moldearlas y adaptarlas a diferentes formas y
aplicaciones.
Sin embargo, en sentido concreto, nombra ciertos tipos de materiales
sintéticos obtenidos mediante fenómenos de polimerización o multiplicación
semi-natural de los átomos de carbono en las largas cadenas moleculares de
compuestos orgánicos derivados del petróleo y otras sustancias naturales.
La
palabra plástico se usó originalmente como adjetivo para denotar un escaso
grado de movilidad y facilidad para adquirir cierta forma, sentido que se
conserva en el término plasticidad. sustancias de distintas estructuras y
naturalezas que carecen de un punto fijo de ebullición y poseen durante un
intervalo de temperaturas propiedades de elasticidad y flexibilidad que
permiten moldearlas y adaptarlas a diferentes formas y aplicaciones.

lunes, 29 de abril de 2013
Reacción Redox de Disminución o Desproporcicion
Llamada también de autoreduccion o desproporcicion, es aquella donde un mismo elemento se oxida y se reduce por lo tanto una misma sustancia química es oxidante y reductor.
jueves, 25 de abril de 2013
Reaccion Intramolecular
En este caso, el elemento que se oxida y el elemento que se oxida y el elemento que se reduce se encuentra en el mismo compuesto por lo tanto el agente oxidante y el agente reductor son sustancias también diferentes.
lunes, 22 de abril de 2013
Reaccion Redox Intermolecular
Son las mas comunes se caracterizan porque el elemento que se oxida y el elemnto que se reduce se encuentran en sustancias químicas diferentes, por lo tanto el agente oxidante y el agente reductor son sustancias también diferentes.
jueves, 18 de abril de 2013
Reacción Redox
Son aquellas que ocurren mediante transferencia de electrones, por lo tanto hay sustancias que pierden electrones (se oxidan) y otras que ganan electrones.
lunes, 15 de abril de 2013
La Oxidacion un tipo de cambio Quimico
Reducción:
Es la ganancia de electrones por parte de una especie quimica.
Oxidacion:
Perdida de elecrones por parte de una especie quimica
La Oxidacion comunmente se define como resultado de la interaccion entre el oxigeno y las diversas sustancias.
Sin embargo oxidacion es un proceso que va mas haya se presenta junto con una reduccion es decir cuando hay una reaccion quimica, una de las especies gana electrones (Reduccion) y la otra pierde electrones (oxidacion).
Sin embargo oxidacion es un proceso que va mas haya se presenta junto con una reduccion es decir cuando hay una reaccion quimica, una de las especies gana electrones (Reduccion) y la otra pierde electrones (oxidacion).
Agente Oxidante
Se denomina Agente Oxidante a aquella sustancia que se reduce provocando en la otra una perdida de electrones.
Agente Reductor
Es aquella sustancia que sufre una oxidacion es decir pierde electrones.
jueves, 11 de abril de 2013
Reaccion de Neutralizacion
Neutralizacion: Es la que se produce por la interpretación entre un ácido y una base, el resultado nos da un compuesto salino y agua.
lunes, 8 de abril de 2013
Ácidos y Bases
Ejemplos de Acidos y Bases
- Hidróxido de Cromo Cr(OH)3
- Hidróxido de Bario Ba(OH)2
- Hidróxido de Litio LiOH
- Hidróxido de Hierro Fe(OH)3
- Hidróxido de Calcio Ca(OH)2
- Ácido Clorhídrico ClH
- Ácido Sulfúrico SO4H2
- Ácido Bórico BO3H3
- Ácido Nítrico HNO3
- Ácido Bromhídrico HBr
jueves, 21 de marzo de 2013
Ácidos y Bases
Ácidos "Propiedades"
- Conducen la corriente eléctrica cuando están disueltos en agua.
- Algunos metales (Zn, Mg...) reaccionan con los ácidos desprendiendo hidrógeno (H2)
- Presentan sabor agrio, el denominado sabor ácido
- Reaccionan con el mármol, desprendiendo CO2
- Modifican el color de las sustancias denominados indicadores (generalmente a color rojo)
- Corroen la piel.

Bases "Propiedades"
- Conducen la corriente eléctrica cuando están disueltos en agua
- Tienen sabor amargo y son untuosas ( jabonosas) al tacto
- Reaccionan con los ácidos produciendo sustancias totalmente diferentes (bases)
- Modifican el color de las sustancias denominados indicadores (generalmente a color azul)
- Inflamables

lunes, 18 de marzo de 2013
Tabla de Radicales
Radical Nombre N. de Oxidacion
HCO3 Carbonato Acido -1
CO3 Carbonato -2
ClO3 Clorato -1
OH Hidroxido -1
NO3 Nitrato -1
MnO4 Permanganato -1
CrO4 Cromato -2
SiO3 Silicato -2
SO4 Sulfato -2
BO3 Borato -3
PO4 Fosfato -3
HCO3 Carbonato Acido -1
CO3 Carbonato -2
ClO3 Clorato -1
OH Hidroxido -1
NO3 Nitrato -1
MnO4 Permanganato -1
CrO4 Cromato -2
SiO3 Silicato -2
SO4 Sulfato -2
BO3 Borato -3
PO4 Fosfato -3
jueves, 14 de marzo de 2013
Tipos de Reacciones
Reacción de Síntesis
Es un proceso elemental en el que dos sustancias químicas reaccionan para general un solo producto. Algunas, se dan al combinar un oxido básico con agua.
Reacción de Descomposición
Es un proceso que experimentan algunos compuestos químicos en el que a partir de una sustancia compuesta se originan dos o mas sustancias de estructura química mas simple es el proceso opuesto a la síntesis.
Reacción de Sustitución Simple
Se presenta cuando un elemento químico mas activo o mas reactivo que se encuentra formado que ha sido parten de un compuesto.
Reacción de Doble Sustitución
En estas reacciones hay dos centros de reacción que intercambian uno de sus sustituyentes. Estas reacciones son frecuentes en la química de los hidruros y halogenos. El mecanismo mas frecuente es el denominado concertado de cuatro centros.
lunes, 11 de marzo de 2013
Balanceo de Ecuaciones Quimicas
Balancear o ajustar una ecuación química es obtener los coeficientes indicados para que en nuestra reacción se cumpla la ley de la conservación de la materia enunciada por Lavoiser que en pocas palabras expresa "En una reacción la cantidad de átomos de un elemento en reactivos debe ser igual a la cantidad obtenida en los productos"
ejemplo:

ejemplo:

Ácidos y Bases
caracterizacion
Ácidos
|
Bases
|
| Tienen sabor agrio (limón, vinagre, etc). | Tiene sabor cáustico o amargo (a lejía) |
| En disolución acuosa enrojecen la tintura o papel de tornasol | En disolución acuosa azulean el papel o tintura de tornasol |
| Decoloran la fenolftaleína enrojecida por las bases | Enrojecen la disolución alcohólica de la fenolftaleína |
| Producen efervescencia con el carbonato de calcio (mármol) | Producen una sensación untuosa al tacto |
| Reaccionan con algunos metales (como el cinc, hierro,…), desprendiendo hidrógeno | Precipitan sustancias disueltas por ácidos |
| Neutralizan la acción de las bases | Neutralizan la acción de los ácidos |
| En disolución acuosa dejan pasar la corriente eléctrica, experimentando ellos, al mismo tiempo una descomposición química | En disolución acuosa dejan pasar la corriente eléctrica, experimentando ellas, al mismo tiempo, una descomposición química |
| Concentrados destruyen los tejidos biológicos vivos (son corrosivos para la piel) | Suaves al tacto pero corrosivos con la piel (destruyen los tejidos vivos) |
| Enrojecen ciertos colorantes vegetales | Dan color azul a ciertos colorantes vegetales |
| Disuelven sustancias | Disuelven grasas y el azufre |
| Pierden sus propiedades al reaccionar con bases | Pierden sus propiedades al reaccionar con ácidos |
| Se usan en la fabricación de jabones a partir de grasas y aceites |

jueves, 7 de marzo de 2013
Energía de Activacion
La energía de activación que se requiere para que se separen los átomos y se inicie una reacción química.
lunes, 4 de marzo de 2013
jueves, 28 de febrero de 2013
Reacción endotermica
La reacción Endotermica es ruptura de los viejos enlaces, que requiere energía.


lunes, 25 de febrero de 2013
Los indicadores de que esta ocurriendo una reacción quimica
- producir gases
- emitir gas o calor
- cambios en el color
- la textura
- el aroma

Factores que modifican la velocidad de una reacción
La TEMPERATURA ya que las moléculas están en constante movimiento, chocando mas rápido.

miércoles, 20 de febrero de 2013
simbologia empleada en ecuaciones quimicas
simbolo lectura
+ reacciona con
----> produce
(S) estado solido
(g) estado gaseoso
(l) estado liquido
(ac) disolucion acuosa
------>
<------ reversible
lunes, 18 de febrero de 2013
jueves, 14 de febrero de 2013
Cambio Fisico
Cuando la materia cambia de forma, color, temperatura, pero siguen conservando su esencia.


lunes, 11 de febrero de 2013
Reaccion Quimica
Es la interacción en dos o mas sustancias que al sufrir un cambio dan origen a otras totalmente diferentes a las que les dieron origen.
viernes, 8 de febrero de 2013
propiedades atómicas en la tabla periodica
se llama propiedad periódica debido a que en ellas hay un orden o una secuencia entre otras se encuentran las siguientes:
el numero atómico aumenta en la tabla periódica de izquierda a derecha en un periodo y de arriba hacia abajo en una familia.
la masa atómica de un elemento aumenta en relación al numero atómico.
numero atómico:
indica el numero de protones en un átomo.el numero atómico aumenta en la tabla periódica de izquierda a derecha en un periodo y de arriba hacia abajo en una familia.
masa atómica
indica la suma de protones y neutrones de u átomo.la masa atómica de un elemento aumenta en relación al numero atómico.
radio atómico
es la distancia existente desde el núcleo hasta el nivel de valencia y por lo tanto indica el tamaño del átomo.
el radio atómico aumenta en la misma forma que lo hacen el numero y la masa.
electronegatividad
es la capacidad que tiene un átomo para atraer los electrones de otro.
lunes, 4 de febrero de 2013
Enlace metalico
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como una nube) de los metales entre sí.
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el cuerpo.
En este tipo de estructura cada átomo metálico está dividido por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales. Este enlace sólo puede estar en sustancias en estado sólido.
Los metales poseen algunas propiedades características que los diferencian de los demás materiales. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y tienen un punto de fusión alto.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente presentan brillo y son maleables. Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen. La vinculación metálica es no polar, apenas hay diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación (en los metales, elementales puros) o muy poca (en las aleaciones), y los electrones implicados en lo que constituye la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y conbrillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones deslocalizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes identificados.
miércoles, 30 de enero de 2013
Enlace Covalente
Son las fuerzas que mantienen unidos entre si a los átomos no metálicos se forman al compartir un par de electrones los dos átomos hasta llegar a la de gas noble, para estar estables se produce entre gaseosos o no metálicos, los dos átomos comparten uno o mas pares electrones en nuevo tipo orbital.
Covalente polar
Tiene una electronegatividad entre 1.7 a 0.4
Covalente apolar (no polar)
Cuando un átomo se une con otro de diferente electronegatividad menor a 0.4
Características
La mayoría son líquidos o gases, algunos son sólidos blandos, tienen densidad, punto de ebullición y fusión menores. son malos conductores de calor y electricidad.
lunes, 28 de enero de 2013
Enlace Ionico
Es la unión de átomos que resulta de la presencia de atracción electrostática, entre metales y no metales, entre los elementos de las familias 17A,1A y 2A.
características:
- punto de fusión elevado 300º hasta 1000º
- sólidos cristalinos
- solubles en agua
- conducen la electricidad fundidos o en disoluciones
- no conducen en estado solido
jueves, 24 de enero de 2013
enlace quimico
es la unión de dos átomos o mas átomos que se han unido con un solo fin alcanzar la estabilidad, tratar de parecerse al gas noble. se lleva acabo mediante, ganancia, perdida o compartimento de electrones mediante los átomos que intervienen.
lunes, 21 de enero de 2013
Que es Quimica
La ciencia que estudia tanto la composición, estructura y propiedades de la materia como los cambios que ésta experimenta durante las reacciones químicas y su relación con la energía.
La química inorgánica, que estudia la materia inorgánica; la química orgánica, que trata con la materia orgánica; la bioquímica, el estudio de substancias en organismos biológicos; la físico-química, que comprende los aspectos energéticos de sistemas químicos a escalas microscópicas, moleculares y atómicas; la química analítica, que analiza muestras de materia y trata de entender su composición y estructura.

La química inorgánica, que estudia la materia inorgánica; la química orgánica, que trata con la materia orgánica; la bioquímica, el estudio de substancias en organismos biológicos; la físico-química, que comprende los aspectos energéticos de sistemas químicos a escalas microscópicas, moleculares y atómicas; la química analítica, que analiza muestras de materia y trata de entender su composición y estructura.

Suscribirse a:
Comentarios (Atom)