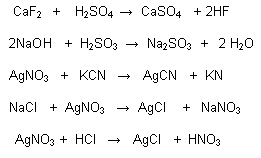jueves, 28 de febrero de 2013
Reacción endotermica
La reacción Endotermica es ruptura de los viejos enlaces, que requiere energía.


lunes, 25 de febrero de 2013
Los indicadores de que esta ocurriendo una reacción quimica
- producir gases
- emitir gas o calor
- cambios en el color
- la textura
- el aroma

Factores que modifican la velocidad de una reacción
La TEMPERATURA ya que las moléculas están en constante movimiento, chocando mas rápido.

miércoles, 20 de febrero de 2013
simbologia empleada en ecuaciones quimicas
simbolo lectura
+ reacciona con
----> produce
(S) estado solido
(g) estado gaseoso
(l) estado liquido
(ac) disolucion acuosa
------>
<------ reversible
lunes, 18 de febrero de 2013
jueves, 14 de febrero de 2013
Cambio Fisico
Cuando la materia cambia de forma, color, temperatura, pero siguen conservando su esencia.


lunes, 11 de febrero de 2013
Reaccion Quimica
Es la interacción en dos o mas sustancias que al sufrir un cambio dan origen a otras totalmente diferentes a las que les dieron origen.
viernes, 8 de febrero de 2013
propiedades atómicas en la tabla periodica
se llama propiedad periódica debido a que en ellas hay un orden o una secuencia entre otras se encuentran las siguientes:
el numero atómico aumenta en la tabla periódica de izquierda a derecha en un periodo y de arriba hacia abajo en una familia.
la masa atómica de un elemento aumenta en relación al numero atómico.
numero atómico:
indica el numero de protones en un átomo.el numero atómico aumenta en la tabla periódica de izquierda a derecha en un periodo y de arriba hacia abajo en una familia.
masa atómica
indica la suma de protones y neutrones de u átomo.la masa atómica de un elemento aumenta en relación al numero atómico.
radio atómico
es la distancia existente desde el núcleo hasta el nivel de valencia y por lo tanto indica el tamaño del átomo.
el radio atómico aumenta en la misma forma que lo hacen el numero y la masa.
electronegatividad
es la capacidad que tiene un átomo para atraer los electrones de otro.
lunes, 4 de febrero de 2013
Enlace metalico
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como una nube) de los metales entre sí.
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el cuerpo.
En este tipo de estructura cada átomo metálico está dividido por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales. Este enlace sólo puede estar en sustancias en estado sólido.
Los metales poseen algunas propiedades características que los diferencian de los demás materiales. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y tienen un punto de fusión alto.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente presentan brillo y son maleables. Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen. La vinculación metálica es no polar, apenas hay diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación (en los metales, elementales puros) o muy poca (en las aleaciones), y los electrones implicados en lo que constituye la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y conbrillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones deslocalizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes identificados.
Suscribirse a:
Comentarios (Atom)